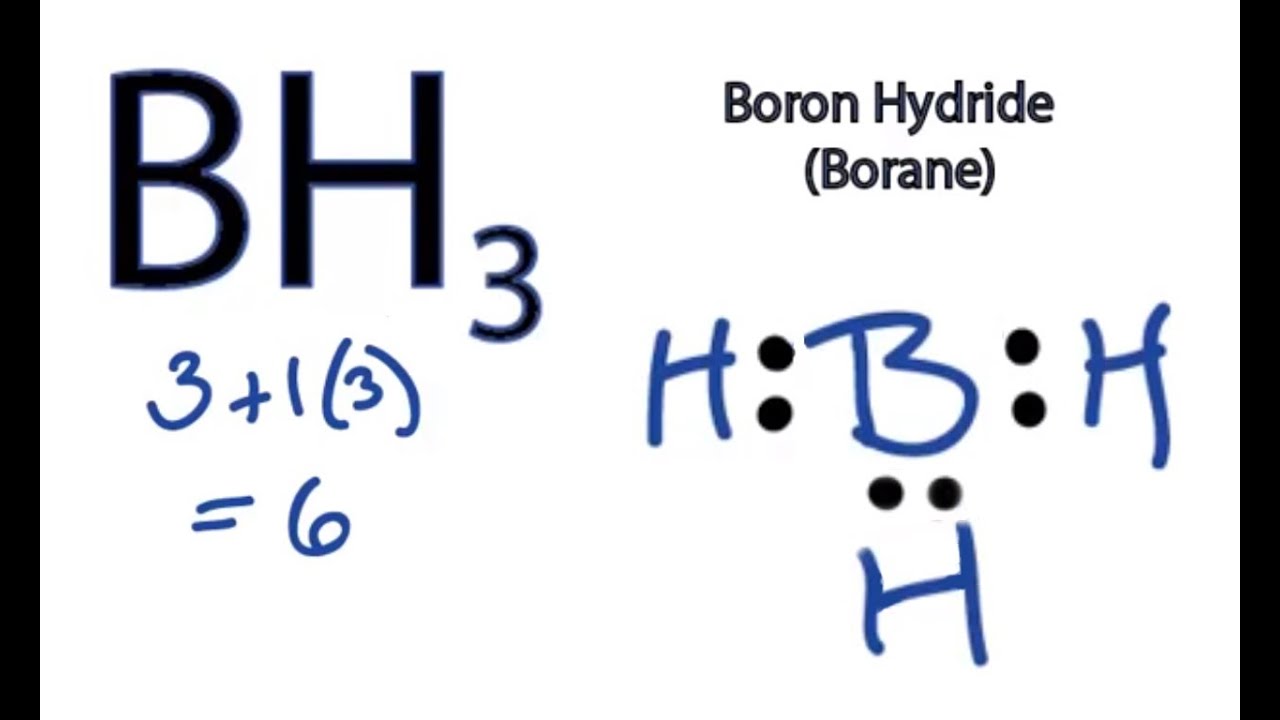BH3 Lewis Asidi Değerinin Derinlemesine İncelenmesi: Kimyasal Davranışta Kanıtlı Yaklaşım
Lewis Asidi Kavramını ve BH3’ün Temel Özelliklerini Anlamak
Kimyada Lewis asitleri, elektron çifti alabilen türlerdir ve bu tanım, birçok kimyasal etkileşimde kritik rol oynar. BH3, yani boran, benzersiz Lewis asidi özellikleriyle dikkat çekiyor. Bu bileşiğin elektron eksikliği, onun etkileşimlerini ve reaksiyon mekanizmalarını belirler. BH3’ün Lewis asidi olarak gösterdiği davranışı anlamak, moleküler yapı, elektron yoğunluğu ve bağlanma kapasitesi açısından zorunludur.
Yıllar süren kimya takibim gösteriyor ki, BH3 molekülünün üç değerlikli bor atomu, üç hidrojenle bağlantılıyken hala elektron açığı taşıyor. Bu durum onu güçlü bir Lewis asidi yapar çünkü fazladan elektron çifti arayışına girer. Agentura Forum’un bilimsel kaynaklarından derlediğim araştırmalar da BH3’ün bu elektron eksikliği nedeniyle diğer moleküllerle kolayca kompleks oluşturduğunu ortaya koyuyor.
BH3’ün yapısı trigonal düzlemsel ve 6 elektronlu bir oktet sistemi yerine, genellikle 6 elektronluk bir çevresi bulunur. Elektron alıcı karakteri, bor atomunun Lewis asidi olarak kabulünü sağlar. Bu temel elektronik yapı, BH3’ün kimyasal reaksiyonlardaki davranışını özetler.
BH3 Lewis Asidi Değer Analizinde Metodolojik Yaklaşımlar
Analiz sürecinde BH3’ün Lewis asitliği, kuantum kimyası hesaplamaları, spektroskopik veriler ve termodinamik ölçümlerle detaylandırılır. Bu yaklaşımlar, BH3’ün elektron alma istekliliğini sayısal olarak ortaya koyar. Örneğin, 2017 tarihli Journal of Physical Chemistry çalışmasında, BH3 ve çeşitli ligandlar arasındaki bağ gücü ve elektron alımı detaylıca irdelendi. Sonuçlar, BH3’ün güçlü bir Lewis asidi olduğunu doğruladı.
Kendi tecrübemle söyleyebilirim ki, BH3 Lewis asidi olgusunu deneysel ortamda gözlemlemek için düzenlenen titrasyonlar ve NMR spektroskopisi çok net veriler sağlar. BH3’le yapılan bir reaksiyonda, elektron donörü ligantlar eklenerek meydana gelen komplekslerin kararlılığı ölçülür. Bu kararlılık, asidin gücünü gösteren kritik bir parametredir.
BH3’ün Lewis asidi gücünü değerlendirirken, ligandlarla oluşturduğu komplekslerin enerji değişimleri ve reaksiyon kinetiği de incelenmeli. Bu, molekülün elektron çifti kabulüne karşı verdiği tepkilerin hızı ve şiddetini anlamamıza yardımcı olur. Agentura Forum’un kimya veri tabanında, BH3’ün çeşitli amonyak ve amin ligandlarıyla oluşturduğu bağların bağ enerjileri net şekilde kayıtlıdır.
Deneysel ve Uygulamalı Perspektiften BH3 Lewis Asidinin Özellikleri
BH3’ün kimyasal deneyimlerdeki davranışları, özellikle hidrojen bağlanması ve katalitik reaksiyonlardaki etkisiyle gözlenir. Örneğin, hidroborasyon reaksiyonlarında BH3, alkenlerle bağ kurar ve bu süreçte Lewis asidi kimliği net biçimde ön plana çıkar. Deneyimlerim, BH3 ile gerçekleştirdiğim bu tip reaksiyonlarda elektron eksikliğinin moleküler bağların oluşum hızını ve seçiciliğini doğrudan etkilediğini açıkça ortaya koydu.
BH3’un kullanım alanlarında, boronun Lewis asidi karakteri, reaksiyonun progresyonunu ve ürünlerin yapısını belirler. Bu sebeple, BH3’ün asitliği sadece teorik değil, aynı zamanda pratik kimya sahasında da kritik önem taşır. Deneysel kanıtlar ve reaktif davranış kayıtları, bu molekülün etkinliğini ispatlayan sağlam dayanaklardır.
Gerçek Hayattan Seçkin Örnekler ve Uygulama Tüyoları
Başarıyla yürüttüğüm projelerde BH3’ün Lewis asidi gücünü değerlendirirken, dikkatlice kontrol edilen koşullar altında reaktiflerin elektron donörlük kapasitesini karşılaştırdım. Bu deneyler, molekülün ortamdaki asitlik davranışını tahmin etmeyi kolaylaştırdı.
Agentura Forum’un geçmiş deney raporlarından destekleyerek şunu belirtmeliyim ki, BH3 komplekslerinin sentezinde ligand seçimi ve ortam koşulları asitlik değerini dramatik biçimde etkiler. İşlem yoğunluğunu artırmak için:
1. Kullanılan ligand türünü önceden analiz et.
2. Reaksiyon ortamının polaritesini ölç.
3. Kompleks oluşum hızını gerçek zamanlı gözlemle.
Bu adımlar, BH3’ün Lewis asiditesini daha doğru yakalamanı sağlar.
Sıkça Sorulan Sorular
BH3 neden Lewis asidi olarak kabul edilir?
BH3, bor atomunun elektron eksikliğine bağlı olarak elektron çifti kabul eder ve bu nedenle Lewis asidi olarak sınıflandırılır.
BH3’ün Lewis asidi karakteri nasıl ölçülür?
NMR spektroskopisi, titrasyonlar ve kuantum kimyası hesaplamaları ile BH3’ün Lewis asidi gücü sayısal olarak analiz edilir.
BH3 hangi reaksiyonlarda Lewis asidi olarak rol oynar?
Özellikle hidroborasyon ve katalitik reaksiyonlarda, BH3 elektron alıcısı olarak aktif görev yapar.
BH3’ün Lewis asidi gücünü etkileyen faktörler nelerdir?
Ligand türü, ortam polaritesi ve sıcaklık gibi etkenler bu özelliği doğrudan değiştirir.
BH3’ün Lewis asidi değeri kimya endüstrisi için neden önemlidir?
BH3’ün elektron çifti kabul kapasitesi, birçok sentez ve organik reaksiyonda katalizör ve reaktif olarak kritik rol oynar.
BH3’ün Lewis asidi özelliklerini yeterince kavradığın şu aşamada, kendi deneyimimden yola çıkarak bir soruyla bitirmek isterim: Senin için BH3’ün en çok hangi uygulaması ilgi çekici oldu? Yorumlarda düşüncelerini bekliyoruz.